 |
|||
 |
|||
| ツメガエル透明化割球 | |||
 |
|||
| EGFP-PCNAを発現した透明化割球 | |||
受精卵では、卵核と精子核が接合して早い細胞分裂である卵割を開始する。胞胚期(哺乳類では胚盤胞期)まではほぼ未分化のまま細胞数が増加し、胞胚中期後に細胞分化と形態形成が始まる。これらの発生過程を制御している分子の細胞内での機能を調べるため、脊椎動物の発生モデルの一つである両生類(カエル、イモリ)を用いて、受精卵内での核の行動制御のしくみや胞胚中期の生きた細胞内での細胞周期調節分子の解析をすすめています。
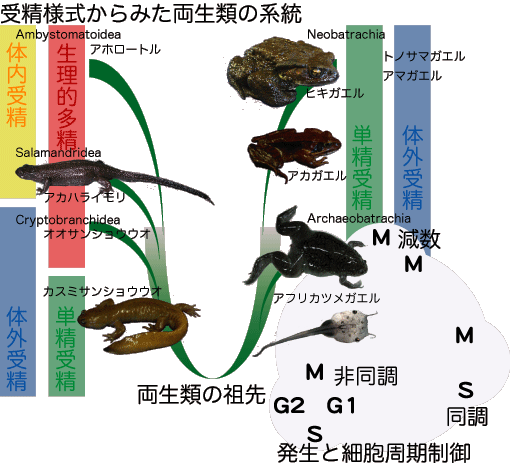
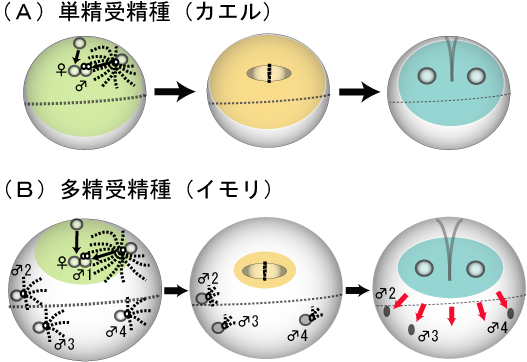
単精受精と多精受精
受精では1つの卵核と1つの精子核が接合する。ところが脊椎動物では精子核が1つのみ卵内に侵入する(単精受精)種と、複数の精子核が侵入する(多精受精)種がある。では、何故複数の精子核が卵内に侵入しても、たった1つの精子核のみが卵核と接合できるのか?
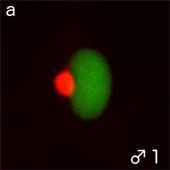
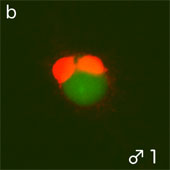
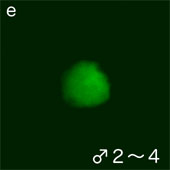
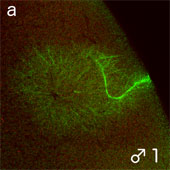
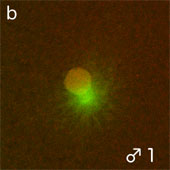
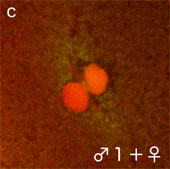
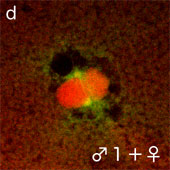
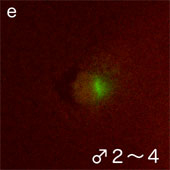
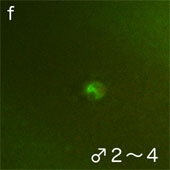
多くの脊椎動物(魚類、カエル、哺乳類)は単精受精をおこない、一つの精子しか卵内に進入しない(図1A)。精子核の中心体から星状体(微小管)ができ、卵核へ移動して接合核となる。また、人為的に多精にした受精卵内での精子核の行動はほぼ同調しており、核の接合までに必要な調節分子が卵内に均一に分布していると考えられる。一方、多精受精をおこなう動物(イモリ、爬虫類、鳥類)では複数の精子(♂1〜4)が受精卵内に入るが、たった一つの精子核(♂1;主精子核)のみが卵核と結合し、残りの精子核(♂2〜4;付属精子核)は消失する(図1B)。こうした精子核の運命の違いは細胞質内での調節分子の分布の偏りによって説明できる(図1B 緑色 ; γ-チューブリンの領域)。
図1 受精から卵割までの接合核の行動と制御分子の分布
(緑;γ-チューブリン、黄色;サイクリンB、青色;後期促進因子活性、赤矢印;DNA分解シグナル、点線(太);微小管、点線(細);赤道面)
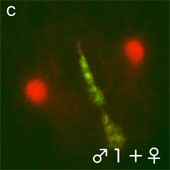
イモリ卵では動物半球の細胞質中に多量のγ−チューブリンが分布し、動物半球の一つの精子核(図2A -a,b ;DNA(緑))の中心体にγ−チューブリンが集積して(図2A -a,b(赤))大きな星状体(図2B -a,b (緑))を形成する。
図2A イモリ受精卵内の精子核と接合核(赤;γーチューブリン、緑;DNA)
(文献Iwao et al.(2002)より引用・改変)
主精子核(+卵核)
付属精子核
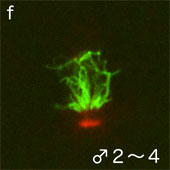
その精子核が卵核へ移動して接合核となり(図2A-c,d)、中心体が複製・分離し、M期へ進行して卵割のための分裂装置を形成する。
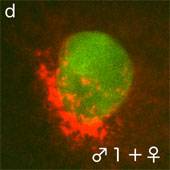
しかし、残りの付属精子核では中心体へのγ−チューブリンの集積はほとんど見られず、矮小の星状体しか形成しない(図2B-e,f)。卵核へ移動できなかった付属精子核は異常凝縮(ピクノシス)を起こし、中心体も消失する(図2A-e,f)。
図2B イモリ受精卵内の精子核と接合核の近辺(赤;CyclinB、緑;微小管)
(文献Iwao et al.(2002)より引用・改変)
主精子核(+卵核)近辺
付属精子核近辺
細胞周期のM期への進行にはM期促進因子(MPF: M phase-promoting factor)であるcdc2 (cdk1)キナーゼ/サイクリンBが必要である。接合核にはサイクリンBが集積してM期へ誘導するが(図2B-b,c,d(赤))、付属精子核ではみられない(図2B-e,f)。余分な精子核でのDNAの断片化や中心体の消失にはアポトーシスと同様のシグナル経路に関与しているのではと考えている。今後、これらの調節分子の解明により、発生の進んだ細胞でも細胞周期の調節に重要である中心体機能を制御できる可能性がある。
初期卵割期の細胞周期制御因子の分布
両生類では、ほぼ12回目の卵割までは約30分(ツメガエル)または約120分(イモリ)の短い周期で細胞分裂(卵割)をおこなう。卵割では細胞成長がなく、同調的な分裂が特徴である。胞胚中期までは細胞質に蓄えられた多くの母性遺伝子産物により制御されており、接合核からのmRNA合成もみられない(初期卵割の周期の長い哺乳類(約14時間、マウス)では分裂の同調性が低く、胚盤胞期以前から若干のmRNA合成が始まる)。こうした両生類の卵割期の早い細胞周期はどのようにして制御されているのか?
イモリ卵のサイクリンBはS期に細胞で合成されており(図A)、cdc2キナーゼとともに核内へ移行してM期を進行させると考えられる。
図A イモリ第8卵割周期(赤;CyclinB、緑;微小管)
(a;S期(初期)、b;S期(後期)、c;前中期、d;M期(中期)、e;M期(後期)、f;M期(終期))
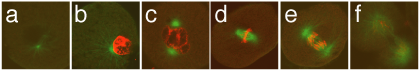
図B ツメガエル第8卵割周期(a~e)と第13卵割周期(f)(赤;Cdc2、緑;微小管)(文献Nakamura et al.(2005)より引用)
(a;S期(初期)、b;S期(後期)、c;前中期、d;M期(中期)、e;M期(後期)、f;間期)
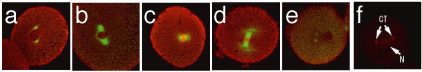
ツメガエルでは、卵割期にサイクリンBが細胞の表層に多く分布しているが、MBT直後には表層の局在が減少する。この減少が細胞の表面積に依存したMBT(中期胞胚転移;胞胚中期から各細胞での分裂周期が伸び、非同調的な分裂となり、接合核からの遺伝子発現も始まる。これは、中期胞胚転移(MBT:Mid-blastula transition)と呼ばれる)期での細胞周期伸長に必要な可能性が示唆される。こうした分布には微小管やマイクロフィラメントなどの細胞骨格系は関与していないことも分かっている。一方、ツメガエルではcdc2キナーゼも表層に多く分布し、S期に核内へ移行する(図B)。cdc2は表層の微小管とマイクロフィラメントに結合しているので、S期中は細胞内でのサイクリンBと局在が異なることでMPF活性が調節されている可能性が考えられる。MBT後は、サイクリンBの表層での局在はみられず、チロシン残基がリン酸化された不活性型cdc2キナーゼが中心体と核内に出現する。
細胞周期と形態形成
MBT以降に細胞周期は伸長し、原腸陥入などの形態形成が始まる。その形態形成には細胞運動(細胞移動)が不可欠となる。一方、細胞は分裂期(M期)には移動出来ず、G1期に最も動きやすい。初期発生において正常な形態形成の進行(開始)にはG1期に細胞周期を維持する機構の存在があるのだろうか?
G1期の細胞周期抑制因子であるPTENフォスファターゼは形態形成の直前(MBT期)に核に局在し(図1)、活性化することで細胞増殖を低下させ、原腸陥入を進行している可能性がある。実際、PTENの活性を上げるとMBT以降の細胞周期は通常割球より伸長し、活性を下げると伸長は阻害される(図2)。また、PTENの活性を阻害すると原腸陥入が遅れる。近年、正常細胞(癌化していない)においてPTENの核局在と細胞周期の抑制が密接に関与している可能性が示唆されているため、上記のMBT期のPTENの核移行機構の解明が、初期発生での細胞周期制御の理解に重要であると考えられる。
図1 初期発生におけるPTENの局在変化と仮説モデル(文献Ueno et al.(2006)より引用)
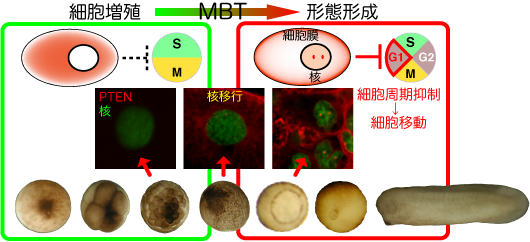
図2 MBT前後のPTEN活性変化(促進・阻害)と細胞周期伸長(文献Ueno et al.(2006)より引用)
Revise.png)
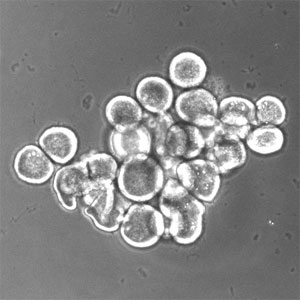
透明化割球
ツメガエル卵は脊椎動物における細胞周期、細胞分化、形態形成などの研究で中心的な役割を果たしている。細胞が大きいためmRNAの注入による外来タンパク質発現や生化学的な解析に適している反面、色素と卵黄が多く不透明なため分子バイオイメージングには適していない。われわれの研究室では、その点を克服するために透明化した細胞(割球)を作成して細胞周期の調節分子を生きた細胞で解析できる実験システムを開発した(文献Iwao et al.(2005))。
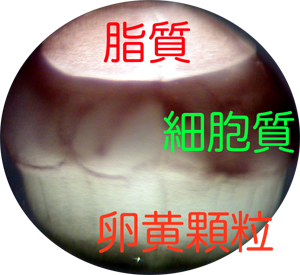
第3卵割周期直前のツメガエル胚をフィコール上で低速遠心すると、細胞の構造を保ったまま、脂質、透明細胞質(核、ミトコンドリア、小胞体など)、色素、卵黄に分層することができる(図1)。
図1 透明化割球作成の概略図
 |
||||||||||||
 |
||||||||||||
 |
||||||||||||
| → | ||||||||||||
| 分層した状態 | 単離後の 透明化割球 |
|||||||||||
| 低速遠心 | ||||||||||||
| 培養 | ||||||||||||
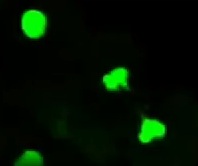
図2 透明化割球の卵割:左から通常の割球、透明化割球、透明化割球中のEGFP-PCNA
画像をクリックすると割球が分裂します(再生にはQuick Timeが必要です)


透明細胞質部分で分裂したものは透明化割球となり、単離後も正常細胞と同様に分裂している(図2中央)。また、S期に必要なPCNA (Proliferating-Cell Nuclear Antigen)の挙動を見るために、あらかじめ1細胞期にEGFP-PCNA mRNAを注入しておくと、発現した蛍光タンパク質がS期に核へ集積し、M期に細胞質へ分散することが観察できる(図2右)。さらに、細胞の核DNAと結合する蛍光色素(Hoechst 33342)を用いて透明化割球での核内DNA量の変化を調べることで、発生段階に対応した細胞周期の位相の変化を生きた個々の細胞において調べることに成功した。MBT前の短い細胞周期ではS期とM期のみがみられ、MBT直後の最初の周期伸長はS期の伸長とG2期の出現によるものである。その後のS期の伸長とG1の出現により、大きく細胞周期が伸びる。S期の伸長は全細胞周期の伸長とよく比例している。一方、ホ乳類の培養細胞ではG1期の長さが全周期長に重要であるとの考えがあるが、少なくとも初期胚では細胞周期の調節が異なりG1期の長さは全周期長に比例しない。また、MBT後の細胞周期は細胞の表面積に反比例して伸長するため、細胞表面(表層)に細胞周期の長さを決定する分子機構があることが示唆されている。この仮説は、核に対する細胞質の比率が通常より多いが、核に対する表面積の比率は変わらない透明化割球においても細胞周期の伸長が通常の割球と変わらないことからも支持される。