Type Bコハク酸脱水素酵素の成熟化機構に関する研究
Sep 26, 2025: Research_Highlights
論文解説: グラム陽性細菌由来コハク酸脱水素酵素のフラビン化機構
–SDH自身のサブユニットがフラビン化を促進する?–
塩田 悠介、高坂 智之
発表のポイント
- これまで明らかになっていなかった、グラム陽性細菌が有するType Bコハク酸脱水素酵素(SDH)のフラビンアデニンジヌクレオチド(FAD)結合機構に関する新たな知見を、大腸菌で異種発現させることで明らかにしました。
- グラム陽性細菌(Corynebacterium glutamicum)由来のSDHを、大腸菌で機能的に発現させることに成功しました。
- 大腸菌でグラム陽性細菌由来のSDHを機能させるには、鉄硫黄サブユニットの成熟化機構を改善する必要がある事を示唆しました。
 |
発表概要
コハク酸脱水素酵素(Succinate dehydrogenase: SDH)は、エネルギー生産や多様な代謝に関わる重要な酵素として知られており、ヒトから細菌まで、様々な環境に生息する生物が有しています。このSDHが機能するには、「フラビン化(flavinylation)」と呼ばれる補欠分子族「フラビンアデニンジヌクレオチド(FAD)」の共有結合が必要不可欠な事が、多くの先行研究によって明らかになっています。しかしながら、グラム陽性細菌が有するType B SDHのフラビン化の詳細な機構はこれまで明らかにされていませんでした。そこで本研究では、3種のグラム陽性細菌(Corynebacterium glutamicum, Bacillus subtilis, Pelotomaculum thermopropionicum)のSDHを大腸菌で異種発現させることで、Type B SDHのフラビン化を含む成熟化機構の解明に取り組みました。
大腸菌で3種のSDHを発現させたところ、FADが共有結合するフラボプロテインサブユニット単体ではFADは結合しませんでしたが、他のサブユニットと同時に発現させた場合にフラビン化が起こりました。さらに、精製酵素による in vitro 試験でも鉄硫黄サブユニットやフマル酸が存在すればフラビン化は促進されることが明らかになりました。つまり、グラム陽性細菌のType B SDHのフラビン化機構はこれまでに明らかとなっているSDHのものとは異なることが示唆されました。
本研究の成果は、SDHのフラビン化における新たな知見を提供し、微生物代謝工学や新たな生理機構の解明に貢献すると考えられます。
 |
|---|
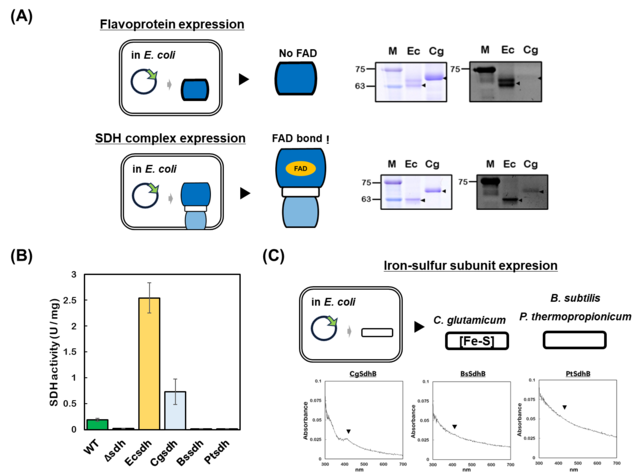
| 図1. (A)異種発現させたコハク酸脱水素酵素のFAD結合比較 (B)異種発現させたSDHの酵素活性比較 (C)異種発現させた鉄硫黄サブユニットの鉄硫黄クラスター検出 |
発表内容
コハク酸脱水素酵素(SDH)は、TCA回路と電子伝達系の両方に関与し、エネルギー代謝をはじめとする様々な代謝に関わる重要な複合体酵素です。SDHは反応の中心となり、補欠分子族フラビンアデニンジヌクレオチド(FAD)が結合するフラボプロテインサブユニット、FADからの電子を伝達する鉄硫黄クラスターを持つ鉄硫黄サブユニット、膜と結合してキノン還元を行う膜結合サブユニットから構成されています。これらの構成サブユニットの数や基質の種類によってSDHはType AからType Fまでの6つに大きく分類されます。SDHの機能において特に重要なのが、フラボプロテインサブユニットへのFADの結合、すなわちフラビン化(flavinylation)であることは、多くの先行研究によって示されており、Type AやType C SDHにおいてはフラビン化機構が明らかにされてきました。しかしながら、私たちが研究対象としているグラム陽性細菌が持つType B SDHについては、これらの機構は明らかにされていませんでした。本研究では、いまだ明らかにされていないフラビン化機構を明らかにすることを目的に、大腸菌を宿主として異種発現を行い、in vivo と in vitro でフラビン化機構の再構築を試みました。
その結果、3種のグラム陽性細菌(Corynebacterium glutamicum, Bacillus subtilis, Pelotomaculum thermopropionicum)のSDHのフラボプロテインサブユニットを単独で大腸菌に発現させてもフラビン化は起こらず、他のサブユニットとの共発現がフラビン化に必要であることを明らかにしました(図1A)。さらに、in vitro でのフラビン化再構築実験によって、鉄硫黄サブユニットまたはフマル酸の存在がType B SDHのフラビン化を促進することを明らかにしました。また、大腸菌細胞内で機能したSDHは C. glutamicum のSDHのみであり、B. subtilis と P. thermopropionicum のSDHはFADが結合するものの、機能はしませんでした(図1B)。そして、精製タンパク質の分析により、この機能しない原因はSDH鉄硫黄サブユニットへの鉄硫黄クラスター挿入にあることを突き止めました(図1C)。
本研究で得た結果により、グラム陽性菌由来Type B SDHのフラビン化機構について、複合体の他のサブユニットやフマル酸が関与するという新たな知見を得ることができました。このSDHに関する知見は酵素及び代謝工学への応用が期待できます。また、私たちの研究成果が示すように、難培養微生物が持つ機能を解析するには異種細胞内や細胞外でその機構を再構築する手法が有効です。
論文情報
雑誌名: Bioscience, Biotechnology, and Biochemistry
論文タイトル: Insight on flavinylation and functioning factor in Type B succinate dehydrogenase from Gram-positive bacteria
著者: Yusuke Shiota and Tomoyuki Kosaka
DOI: 10.1093/bbb/zbaf026
研究助成
本研究は、国立研究開発法人科学技術振興機構次世代研究者挑戦的研究プログラム(JPMJSP2111)、日本学術振興会科学研究費補助金(21K05343)および公益財団法人発酵研究所(LA-2023-018)の支援により実施されました。
用語解説
- コハク酸脱水素酵素(SDH):コハク酸をフマル酸に酸化する反応を触媒する酵素です。TCA回路と電子伝達系のどちらにも関与する唯一の酵素です。
- TCA回路:真核生物のミトコンドリア内膜や、好気性細菌の細胞質基質で行われる代謝経路の中心です。
- 電子伝達系:ミトコンドリア内膜や細菌の細胞膜に存在する一連のタンパク質複合体と電子伝達体からなるシステムです。エネルギー生産にきわめて重要です。
- 補欠分子族:酵素タンパク質に強固に結合する非タンパク質性の低分子化合物です。それぞれの酵素が要求する補欠分子族は触媒活性に必須なことが知られています。
- FAD (フラビンアデニンジヌクレオチド):ヌクレオチドの一種で、酸化還元反応に関わる重要な補酵素です。SDHをはじめとする多くの酵素の補欠分子族です。
- グラム陽性細菌:細菌の分類の一つで、グラム染色という染色法で紫色に染まる細菌のグループです。
- Corynebacterium glutamicum (コリネバクテリウム・グルタミカム):グラム陽性細菌の一種で、工業的にアミノ酸(特にグルタミン酸)の生産に広く利用されています。
- Bacillus subtilis (バチルス・サブチリス):グラム陽性細菌の一種で、土壌や植物に広く分布しています。タンパク生産や、遺伝子研究のモデル生物としても利用されています。
- Pelotomaculum thermopropionicum (ペロトマキュラム・サーモプロピオニカム):嫌気性のグラム陽性細菌の一種で、世界でも報告の少ない共生的プロピオン酸代謝を行える菌の1種です。