研究内容紹介
がんの治療には従来、三大標準療法と呼ばれる外科療法・化学療法・放射線療法が適用され、多くの命を救ってきました。しかし、我が国では1981年以降40年以上にわたりがんが死亡原因の一位であり続け、その傾向には歯止めがかかっていません。厚生労働省の統計によれば、2023年の全死亡者に占める割合は 24.3%であり、これは日本国内の全死亡者の約4人に1人が、がんで死亡したことを意味しています。また、がん患者の診断や治療に費やされる医療費は著しく増大し、日本の経済を圧迫する一因にもなっており、がんに対する優れた診断技術の確立や効果的な治療法・再発予防法の開発が求められています。現在、従来の三大標準療法の適応が困難ながんに対する治療法として、がん免疫療法の基礎研究・臨床開発が活発に行われています。なかでも2018年のノーベル生理学・医学賞の対象となった免疫チェックポイント阻害療法は、今や新たな標準療法として確立するまでに広く普及しています。
さらに、免疫チェックポイント阻害療法に続き、遺伝子改変型T細胞療法も次世代のがん免疫療法として高い注目を集めています。その代表格であるCAR-T細胞療法は、患者から免疫細胞(T細胞)を採取し、体外にてがん細胞を特異的に認識する一本鎖抗体とT細胞の活性化を誘導するシグナル伝達ドメインから構成される人工受容体であるキメラ抗原受容体(Chimeric Antigen Receptor: CAR)を遺伝子導入し、投与する治療法です。CAR-T細胞療法は白血病やリンパ腫などの血液がんに対して極めて高い治療効果を示し、2019年には我が国でも承認されました。一方で、臨床応用が進むにつれて様々な臨床的課題も浮き彫りになってきました。例えば、サイトカイン放出症候群や神経毒性のような重篤な有害事象、on-target off-tumor活性による正常臓器に対する傷害、CAR-T細胞の疲弊や標的分子の消失による腫瘍再発などが報告されています。また、現在のCAR-T細胞療法は固形がんに対する効果が不十分であることが知られています。これらの課題を克服するために、我々は様々な免疫学的側面よりアプローチをしながら次世代型のCAR-T細胞療法の研究開発に取り組んでおり、そのひとつがPRIME CAR-T細胞(Proliferation-inducing and migration-enhancing CAR-T細胞)療法です。
PRIME CAR-T細胞は、患者さん自身の免疫機能もがん攻撃に参画させるというコンセプトをもとに開発した次世代型CAR-T細胞であり、T細胞の生存や増殖に関与するIL-7とがん局所にT細胞や樹状細胞を集積させるためのCCL19を産生し、投与したPRIME CAR-T細胞のみでなく、内因性の免疫細胞も協調して抗腫瘍効果を発揮させることで固形がんに対して高い治療効果を示すことができました(Adachi K. et al., Nat. Biotechnol. 2018)。現在、PRIME CAR-T細胞療法の臨床開発が進行中です。
<PRIME CAR-T細胞が固形がんに対し治療効果を発揮する機序>
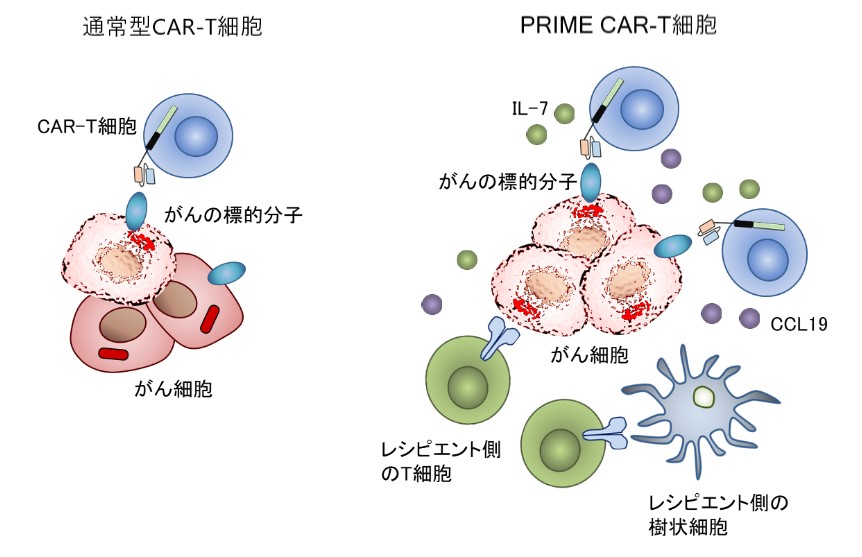
通常型CAR-T細胞(左図)と異なり、PRIME CAR-T細胞の投与(右図)により産生するIL-7及びCCL19の作用によりCAR-T細胞のみならず患者体内のT細胞や樹状細胞の腫瘍組織への集積と増殖が誘導され、相乗的な抗腫瘍効果をもたらすことが明らかとなりました。
このように、我々は基礎研究での成果を更に発展させ臨床現場に還元することを目指し、臨床研究グループとの密接な共同研究やバイオベンチャーを含めたライフサイエンス企業との提携を推進しています。これらの取り組みによって得られる臨床での知見やニーズをさらに今後の基礎研究に反映させ、優れた安全性と有効性を有する新規がん免疫療法を多くの患者さんへ届けることを目標としています。
